

* 本文轉自“非因生物"公眾號
腎細胞癌(RCC)具有血管侵襲的生物學傾向,4-15%的病例可形成腎靜脈或下腔靜脈(IVC)腫瘤血栓(TT)。基于免疫治療的聯合治療(IBCs)已成為治療晚期RCC的一線方法。在IBC治療的背景下,阿西替尼具有半衰期短、反應快、潛在免疫激活等特點,已成為新輔助治療中療效和實用性較理想的手術前用藥。NEOTAX是一項2期研究,旨在研究新輔助治療托帕里單抗聯合阿西替尼治療透明細胞腎細胞癌(ccRCC)和下腔靜脈腫瘤血栓(IVC-TT)的有效性和安全性。張旭院士、馬鑫教授及顧良友教授團隊牽頭開展了這項研究,并在Nature子刊“Signal Transduction and Targeted Therapy"中(IF:40.8)發表學術論著“Neoadjuvant toripalimab plus axitinib for clear cell renal cell carcinoma with inferior vena cava tumor thrombus: NEOTAX, a phase 2 study"。其中,研究利用Cell DIVE單細胞空間蛋白組學技術對19種marker進行9輪循環染色,將臨床研究結果進行了轉化研究及驗證,該部分實驗及分析由非因生物支持完成。
研究方案

研究結果
1.病例納入及數據
2020年3月至2023年10月期間,該單中心研究最終入組25例接受治療的患者(患者納入及干預過程如圖1)。其中,11例患者TT水平降低。新輔助治療可顯著降低腫瘤血栓患者的Mayo水平,其余14例患者血栓水平穩定,Mayo水平均未升高。25例患者中有14例血栓水平穩定,其中13例患者TT長度減少,TT長度的中位變化為- 2.3 cm(范圍:- 7.1至1.1 cm)。新輔助治療12周后,25例患者中有11例IVC-TT達到PR(腫瘤血栓長度縮小>30%),但Mayo水平未升高

2. 術后并發癥及隨訪
21例患者成功行性腎切除術合并下腔靜脈血栓切除術。術后并發癥發生率為57.1%。最常見的輕微并發癥是一過性腎功能不全和術后需要輸血。3例患者出現嚴重并發癥。1例患者出現腎衰竭,需要透析。1例患者出現心肺驟停,需要進行心肺復蘇。1例患者因術中大出血而死于失血性休克和彌散性血管內凝血(V級,死亡率4.8%)。這些主要并發癥均不是由TKI治療或免疫治療引起的。盡管這些是IBC治療后常見的問題,但沒有報道傷口愈合的并發癥。在一些患者中觀察到腹腔內組織粘連,但并沒有導致手術復雜性顯著增加或需要實行開放手術。
整個隊列的中位隨訪時間為23.3個月,中位無進展生存期(PFS)為25.3個月。9例患者出現腫瘤進展(腫瘤復發、新轉移灶出現、原轉移灶進展),其中7例術后進展。1年和2年的PFS分別為89.1%和54.8%(圖2d)。隨訪期間報告了2例死亡(8.0%),其中1例患者出現疾病進展,1例患者死于(圖2c)。

3. 轉化研究
作者收集了18例患者術前原發腫瘤穿刺樣本,通過單細胞空間蛋白組學Cell DIVE技術對包括CD57、CD11b、CD68、PanCK、SMA、CD33、HLA-DR、CD14、CD163、CD45RO、CD68、PD-1、PD-L1、CD20、FoxP3、CD8、CD3、CD4、CD31在內的19種marker進行了循環染色。研究了潛在的分子生物標志物或免疫細胞亞群預測治療效果。研究根據TT響應對患者進行分層(響應組N,無響應組NR),發現無響應組(NR)中細胞毒性T細胞(CD3+CD4?CD8+ CD45RO?)水平較高,其中主要源自PD-1陽性細胞(CD3+ PD1+CD4?CD8+CD45RO?)(圖3a, b, c)。此外,研究發現響應組具有較少的輔助T細胞(CD3+CD4+CD8?FOXP3?CD45RO?),而其亞型:調節性T細胞(CD3+CD4+CD8? FOXP3+CD45RO?)作為另一個主要的免疫抑制T細胞并無顯著變化(圖3b)。以上結果說明雖然無響應組表現出較高的T細胞浸潤,但這些浸潤細胞可能主要是表達PD-1的免疫抑制性T細胞毒性細胞。這些表達PD-1的細胞可能與表達PD-L1的腫瘤細胞相互作用,最終導致對新輔助治療抵抗。因此,術前評估腫瘤穿刺標本中T細胞毒性PD-1/+細胞水平可以作為治療反應的預測指標。

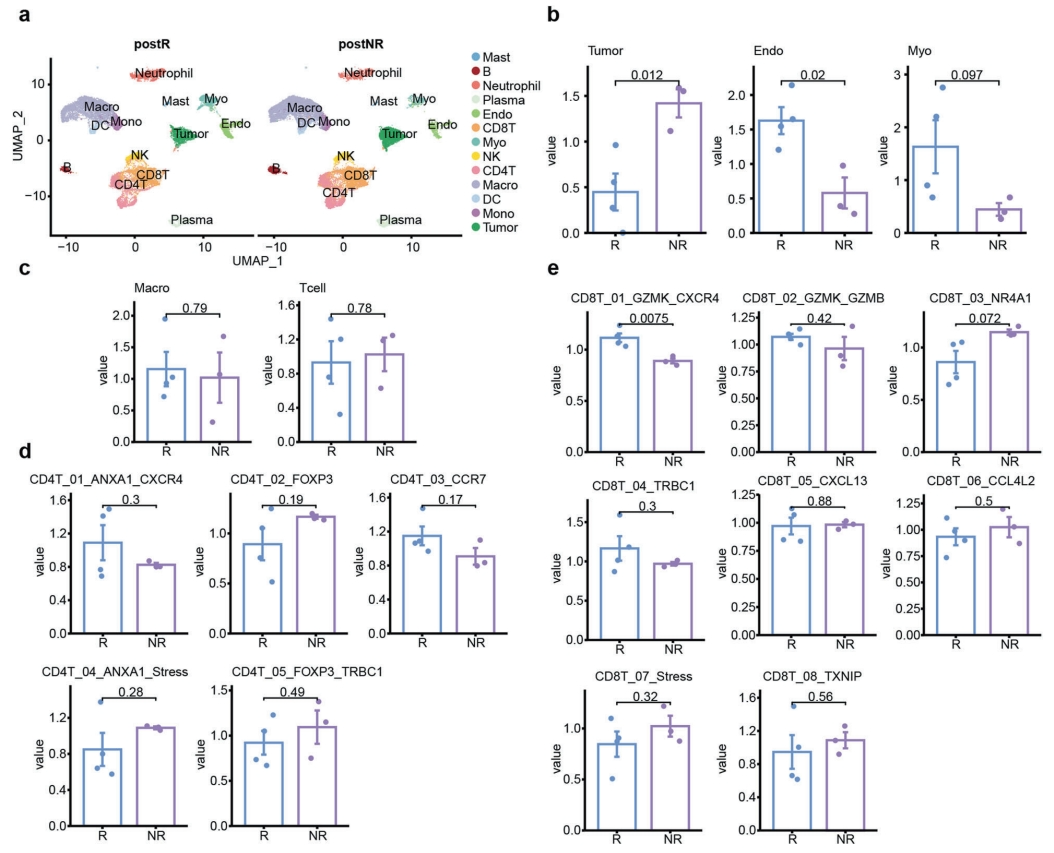
在新輔助阿西替尼治療合并TT的RCC研究中,雖然沒有觀察到統計學差異,但作者發現了相似的T細胞趨勢。作者利用7例患者單細胞測序(scRNA-seq,其中4例來自NR組,3例來自R組)描述了腫瘤微環境的細胞分布。經過嚴格的質量控制,共計獲得41973個細胞,并分為13種主要細胞類型(圖4a)。在NR組的非免疫細胞中,腫瘤細胞比例較高,內皮細胞和成纖維細胞比例較低(圖4b),但免疫細胞無顯著差異(圖4c),這表明T細胞亞群與新輔助治療的療效有潛在的聯系。對免疫細胞亞群進行進一步亞分類,結合多重免疫熒光的結果,發現T細胞的典型標記CD8T_01_GZMK_CXCR4子集發生了顯著變化,而其他子集保持不變(圖4d, e)。此前的研究報道了CD8+ GZMK+具有最高的細胞毒性評分和很低的衰竭評分,這與聯合治療的良好響應有關。
研究結論
這項臨床2期研究表明,托利哌單抗聯合阿西替尼有望降低IVC-TT的分期,并減少ccRCC和IVC-TT患者對廣泛手術治療的需求。此外,術前評估腫瘤穿刺標本中T細胞毒性PD-1/+細胞水平可以作為治療反應的預測指標,并且T細胞亞群可能與RCC-TT患者新輔助治療的有效性有關。
電話
微信掃一掃
